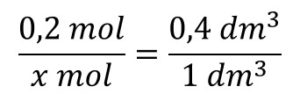1. Mellőzöd a függvénytáblázatot
A négyjegyű függvénytáblázat a kémia érettségi legális puskája. Nem kihasználni ezt a lehetőséget az egyik legnagyobb hiba amit elkövethetsz. Akár egyes feladatok/feladatrészek konkrét megoldását is megtalálhatod benne. TILOS pontot veszteni olyan dolog miatt, ami benne van!
A legtöbb információt a sárga változat tartalmazza kémiából, de akár több kiadást is használhatsz az érettségin. Mi minden van benne:
- Fogalmak (alapmértékegységek definíciói, elemi részecskék, atom, atommag, magerők, magtöltés, rendszám, tömegszám, nuklidok, izotópok, relatív atomtömeg, relatív molekulatömeg, atompálya, kvantumszámok, elektronhéj, alhéj, alapállapotú atom, gerjesztett atom, energiaminimum elve, Pauli-elv, Hund-szabály, atomtörzs, pályaenergia, atomsugár, kovalens sugár, ionsugár, ionizációs energia, elektronaffinitás, elektronegativitás, központi atom, ligandum, kötési energia, elemi cella, rácsenergia, oldhatóság, oxidáció, redukció, oxidációs szám, elektrokémiai reakció, elektrokémiai rendszer, elektród, anód, katód, fémes vezető, diafragma, elektródpotenciál, standardpotenciál, elektromotoros erő, elektrolízis, sav, bázis)
- Elméleti anyagok (A kémiában használatos mértékegységek és fizikai állandók, elemi részecskék és jellemző adataik, az atomok elektronszerkezete, az atomok fizikai adatai, az elemek előfordulása, elsőrendű kémiai kötések, másodrendű kémiai kötések, molekulák geometriája, molekulák és ionok szerkezete, kötéstávolságok, kötési energiák, kristályrácstípusok és jellemzőik, redoxi-reakciók, elektrokémia, sav-bázis rendszerek, szerves nevezéktan).
- Táblázatok (elemek adatai, atomjaik elektronszerkezete, lehetséges oxidációs számok, izotópjaik és előfordulási százalékuk, fémek rácstípusai, vízben oldódó szervetlen vegyületek oldhatósága, a rosszul oldódó anyagok oldhatósági szorzatai, standard potenciál értékek, elektródfolyamatok az elektrolízis közben, Faraday törvények, sav- és bázisállandók, a víz-ionszorzat hőmérséklet-függése, az indikátorok átcsapási tartományai, elemek és szervetlen vegyületek adatai, komplexek, szerves vegyületek adatai).

(Kattints a képre nagyításhoz!)
Fontos, hogy pontosan tudd, mit hol találsz benne, azaz, hogy már a felkészüléskor is aktívan használd! Ha élesben kezdesz el lapozgatni, keresgetni benne, akkor akár még hátrányodra is lehet időveszteség formájában, hiszen a sok információ között gyorsan meg is kell találni a neked szükségeset. Ha viszont pontosan tudod, hogy mit hol keress, akkor az egyik legjobb ,,barátod” lesz mind az írásbeli, mind a szóbeli vizsgán.
Hibák is vannak a függvénytáblázatban:
VIGYÁZAT! Bármennyire is nagyszerű eszköz a sárga függvénytáblázat, néhány hiba azért van benne. Példák:
- Régebbi változatokban (lehet, hogy újabbakban már javítva van) a sav-, és bázisállandók képletében benne van a nevezőben a víz egyensúlyi koncentrációja, pedig nem kell bele. Ugyan az oldal alján szerepel egy megjegyzés, hogy ezek állandók, amelyből következik, hogy ,,elhagyhatók” a képletből, de ha elkerüli a figyelmedet ez a megjegyzés, vagy nem tudod pontosan, hogy mit jelent, akkor hibás lesz a számolásod.
- Még régebbi változatban az alkoholok termodinamikai adatait tartalmazó táblázatból kifelejtették a metanol képletét, így az alkoholok elcsúsztak.
- A karbonsavakat tartalmazó táblázatban a vajsav képlete hibás.
2. Nem használod a periódusos rendszert
Ezt akár az első pontba is írhattam volna, hiszen a függvénytáblázatban ez is megtalálható, de annyira fontos, hogy külön pontot szenteltem neki.
Egy kémiával bármilyen szinten foglalkozó ember (pl. ha kémiából érettségizik) legfontosabb eszköze a periódusos rendszer. Meg kell tanulni kiolvasni belőle a lehető legtöbb információt.
Ezek közül néhány egyértelmű: vegyjel, rendszám, relatív atomtömeg, stb., néhány pedig alaposabb ismeretet, gyakorlatot igényel: főcsoportok, mellékcsoportok, trendek a periódusokban és csoportokban (atomsugár, elektronegativitás, ionizációs energia, …), mezők, vegyértékelektron-szerkezet, vegyértékelektronok száma, párosítatlan elektronok száma, megállapítani két elem között milyen kémiai kötés jöhet létre, stb.
Itt az oldalon is találsz egy nagyon részletes, sok információt tartalmazó periódusos rendszert.
3. Szigorú sorrendben oldod meg a feladatokat
Amikor ,,elstartol” az írásbeli, érdemes átnézned az összes feladatot, hogy miről is lesz szó a vizsgán. Azon a 4-5 percen (a 120/240-ből) nem fog múlni semmi. A vizsga előtti napokban-hetekben úgy is folyamatosan az fog járni a fejedben, hogy ,,vajon mi lesz benne?” Ezt a belső feszültséget ezzel az átfutással rögtön a vizsga elején fel is oldhatod.
Még egy indok elrettentésképpen, hogy miért ne hagyd ki ezt a lépést: Megtörtént eset, hogy egy vizsgázó nem vette észre az utolsó oldalon levő számítási feladatot, örült, hogy milyen gyorsan végzett, és beadta anélkül, hogy egyáltalán tudomása lett volna az utolsó, sok pontot érő számításról!
Amikor megvolt a feladatok átfutása, rögtön látni fogod, hogy melyek azok a kérdések/témakörök, amik neked jól szoktak menni. Érdemes inkább ezekkel kezdeni, mintsem szigorúan sorban haladni, és esetleg leragadni egy-egy részfeladatnál, ami lehet, hogy csak 1 pontos.
Bemelegítés/megnyugvásképpen talán a legjobb, ha a könnyebb, egyszerű választásos tesztekkel kezdesz. Vigyázz azonban, mert ennél a feladatnál könnyű elkövetni a következő típushibákat, mégpedig, hogy:
4. Elkapkodod/üresen hagyod az egyszerű választásokat
Még ha úgy gondolod, hogy azonnal, vagy fejből is tudod a választ, és van is a lehetőségek között olyan amire gondolsz, akkor is érdemes ellenőrizni a többi választási lehetőségről is, hogy biztosan nem megfelelőek. Lehet, hogy először rosszra gondoltál, és ha jobban meggondolod, akkor egy másik a helyes válasz.
Ne kövesd el azt a hibát, hogy figyelmetlenségből nem veszed észre, hogy az egyetlen helytelen/hibásválaszt kérdezik.
B) Naftalin.
C) Anilin.
D) Formamid.
E) Buta-1,3-dién.
Ha véletlenül nem vetted észre elsőnek, hogy a hibás válasz a kérdés, előfordulhat, hogy sietségedben rögtön beírod az A) választ.
De ezt a figyelmetlenséget még mindig korrigálni lehetne, ha nem ugrasz egyből a következő kérdésre, hanem ahogy már említettem, ellenőrzöd a többi választási lehetőséget is. Rögtön rájössz, már a B) lehetőségnél, hogy a naftalin atomjai is egy síkban vannak. Hoppá, két jó válasz nem lehet, mi is volt a kérdés? Ja, hogy melyikre NEM IGAZ. Akkor a C) választ kell beírni, mert a D) és E) molekulákban is egy síkban vannak.
Jobb esetben dőlt betűvel szokták írni, ha a helytelen/hibás/nem igaz esetet kérdezik, de még ekkor is lehet, hogy átsiklasz a valódi kérdés felett a vizsgadrukk miatt. Inkább szánd rá minden feladatnál azt a pár másodpercet arra, hogy alaposan elolvasod a kérdést!
Szintén nagy hiba, ha valamelyikre esetleg nem tudod a választ, és hosszas gondolkodás után nem írsz be semmit. Általánosságban is elmondható, hogy mindenhova írni kell valamit, még ha lehet, hogy hülyeség is, de az egyszerű választásnál meg különösen. Ha nem megy, akkor
zárd ki ami biztosan nem jó, a maradékból pedig tippelj, hátha pont bejön!
Fontos, hogy ha közben áthúztál választ, akár többet is, a végső tipped ne legyen áthúzva, mert csak olyan választ értékelhet a javító ami nincs lehúzva (ez egyébként minden feladatra igaz); illetve, hogy egyértelműen csak egy választ adj meg, ellenkező esetben szintén nem kaphatsz pontot.
5. Nem figyelsz az értékes jegyekre, mértékegységekre, jelölésekre
Bár ez a három dolog összesen csak 2 pont az egész (emelt) írásbelin, de egy magasabb bejutási küszöbű egyetem esetében 1-2 pont is dönthet akár. Ráadásul egy kis odafigyeléssel nem is túl nehéz összeszedni ezt a 2 pontot (mondjuk bevallom, én sem szeretek a helyes értékes jegyekkel bajlódni, de az érettségin mégis megéri!) Oda kell figyelni a jelölések és a mértékegységek helyes használatára nem csak a végeredmények, de a részeredmények esetén is!
Gyorstalpaló az értékes jegyekről:
Általános szabály, hogy egy számítás eredménye nem lehet pontosabb, mint azok az adatok, amelyekből számítottuk azt. Amikor valamilyen kémiai számítást végzünk, akkor az adatokat nem csak úgy kitaláljuk, hanem valamilyen mérésnek az eredményeit használjuk fel.
Egy mérőeszköz esetén mindig van egy határa annak, hogy mennyire pontosan tud mérni. Pl. tegyük fel, hogy meg akarjuk mérni egy anyagnak a tömegét egy laboratóriumi mérlegen. Rátesszük a mérlegre, és azt látjuk, hogy a tömege az anyagnak 5,3 g. A mérleg akkor is ennyit fog kiírni, ha az anyag tömege valójában pontosan 5,250000… g, és akkor is, ha 5,349999… (illetve ezek közötti érték minden esetében)mivel csak ennyire pontosan tudja megadni.
Hogyha valamit ezzel az adattal számolni akarunk, akkor a végeredmény pontosságát ennek az adatnak a pontosságához igazítanunk kell. Sem több, sem kevesebb értékes jeggyel nem szabad megadni a végeredményt, mint ahogy a szabályok szerint szükséges, ellenkező esetben azt állítanánk, hogy pontosabban, vagy kevésbé pontosan ismertük ezt a kiindulási adatot.
Ebben az esetben (5,3 g) kettő értékes jeggyel megadott adatunk van. Mi számít értékes jegynek?
Például a 0,00150 egy 3 értékes jeggyel megadott adat, hiszen az első 0-tól különböző számjegy az 1-es, és utána még két db számjegy áll.
Becsapós kérdés: Hány értékes jegyű ez az adat: 500 cm3 ? A helyes válasz: 1! ,,Miért nem három, a definíció szerint annyinak kellen e lenni?!” – kérdezhetnéd. Viszont a két 0 az 5-ös után csak amolyan nagyságrendre utaló 0-ák, azaz ezt az adatot így is írhatnánk: 5 x 102. Ebből már jól látszik, hogy miért csak 1 értékes jegy a válasz. Ez a dolog minden 0-ra végződő, kerek szám esetén fenn áll.
Hány értékes jegyű ez az adat: 5,00 cm3 ? A helyes válasz: 3. Itt a 0-ák tizedes vessző után állnak, tehát itt nem nagyságrendre utalnak, hanem arra, hogy a térfogatmérő eszköz milyen pontossággal tudta megmérni a kérdéses térfogatot (és nem azért vannak ott, hogy téged idegesítsenek  ). Ilyen jellegű adattal gyakran találkozhatsz kémia érettségis számítási feladatban is. Ez az adat tehát semmiképpen sem 5 cm3 !
). Ilyen jellegű adattal gyakran találkozhatsz kémia érettségis számítási feladatban is. Ez az adat tehát semmiképpen sem 5 cm3 !
Szabályok:
Szorzás és osztás esetén a végeredményt annyi értékes jeggyel adhatjuk meg, amennyi a kiindulási adatok közül a legkevesebb értékes jeggyel ismertben van. Pl. a következő adatokból sűrűséget kell számolnunk: 11,78945 g oldat, amelynek 11,9 cm3 a térfogata. A pontatlanabbul ismert adat a térfogat, amely 3 értékes jeggyel van megadva, tehát a végeredményt is ennyi értékes jeggyel kell megadni. A sűrűség tehát: 11,78945/11,9 = 0,991 g/cm3 . A számológép hiába tudja kiszámolni több értékes jeggyel: 0,990710084, nekünk a kerekítés szabályait alkalmazva 3-mal kell megadnunk.
Összeadás és kivonás esetén: a végeredményt annyi tizedes jeggyel(!) adhatjuk meg, amennyi a kiindulási adatok közül a legkevesebb tizedes jeggyel ismertben van. Pl. 2,844 g + 30,2 g = 33,0 g, nem pedig 33,044 (de nem is 33).
Ha még sincs kedved a szabályokat alkalmazni, akkor legalább azt tedd meg, hogy a végeredményeket mindig 3 értékes jeggyel adod meg. Így nagyon jó eséllyel meg fogod kapni az érte járó pontot, hiszen leggyakrabban ez szokott lenni a helyes.
6. Nem a kért típusú egyenlettel, elektronszerkezettel, elnevezéssel, képlettel válaszolsz
Nagyon oda kell figyelni, hogy egy reakció felírásánál bruttó, vagy ionegyenletet kérdeznek!
Milyen képlettel kell megadni egy anyagot: Összegképlet? Vonalképlet? Konstitúciós képlet? Szerkezeti képlet esetén fel kell-e tüntetni a nemkötő elektronpárokat?
Elnevezésnél hétköznapi, vagy tudományos nevet kérnek? Mindkettőt?
Ha elektronszerkezetet kérdeznek, a teljeset, vagy csak a vegyértékelektronokét? Esetleg cellás ábrázolással kérik? Mindhármat?
7. Rendezetlen, nehezen átlátható a számításod
Ennek két esete van: az egyik, hogy a javító tanár nem látja át, nem találja a kellő eredményeket, így nem is tudja megadni a pontokat/részpontokat. A másik, hogy te magad sem látod át. Így a rendezetlen, rendszertelen adatokból és számolásokból nem áll össze a megoldás menete, és nem lesz meg a helyes végeredmény.
A probléma első felét könnyebb orvosolni. Ha csak nem olvashatatlan, teljesen össze vissza firkált, satírozott, áthúzott a számolás, akkor a javítónak elvileg ki kell bogarásznia, hogy minden meg van-e. Legfeljebb kicsit megnehezíted a dolgát. Persze ha valamire nem kaptál pontot, ami valójában tényleg le volt írva (igazolhatóan), akkor lehet fellebbezni a megtekintés után, de érdemes inkább elejét venni az ezzel járó nyűgnek egy rendezett írásképpel.
Ehhez néhány tipp:
- Próbáld meg elővenni a legszebb írásodat. Ha ez külön erőfeszítést igényel, vagy tudod magadról, hogy gyakran szoktál áthúzni, satírozni, akkor írj piszkozatot, és ha meg van a megoldás, másold be szépen a szükséges helyre.
- Sokszor előfordul, hogy a számolás levezetésének hagyott hely kicsinek bizonyul. Ilyenkor semmiképpen se próbálj minél apróbb betűkkel minél több infót beszorítani ide. Az érettségin akárhány extra, üres lapot használhatsz nem csak piszkozatként, de az értékelendő dolgozat részeként is (ezek az úgynevezett tisztázati lapok). Ezek lepecsételt papírok, amelyet a bent levő tanártól kérhetsz. Ha ilyet használsz mindig jelöld szövegesen az adott feladatrésznél. Pl. ,,folytatás a tisztázati lapon”.
- Használd a képleteket, mértékegységeket, jelöléseket! Ezek rögtön irányba igazítják a javító tanárt, még akkor is, ha egészen kacifántos levezetésed van.
- Ha egy azonos jellegű adatból/mennyiségből több is van (pl. 2 térfogat), akkor jelöld, hogy melyik melyikhez tartozik.
- Az ismeretlent/ismeretleneket célszerűen válaszd meg, és jelöld! Próbálj minél kevesebbet használni!
- Itt is érvényes, hogy ha vannak áthúzások a megoldásban, a végső, helyesnek vélt részek egyértelműek legyenek!
- Célszerű egy-egy összetartozó részletét (például egy aránypárral való számolást) a számításoknak egy egységben/egy helyen levezetni, nem pedig szétszórva, esetleg külön lapokon. Ha látod előre, hogy vélhetően nem fog kiférni, inkább kezdd egy új sorba/oszlopba/új lapon.
Ha te nem látod át a feladatot:
Ez még nagyobb probléma. Ahhoz, hogy ezt elkerüld a felkészülés során tudatosan kell rendezett, rendszerezett módon megoldanod a számításokat.
Amikor már kellő rutint szerzel a kémiai számítási példákban, észre fogod venni, hogy
a hasonló típusú számolásoknál a megoldásnak mindig van egy jól meghatározott menete,
függetlenül attól, hogy milyen módon vezeted le őket (pl. képletekkel/következtetéssel). Vagy a megadott adatokból haladunk a cél felé, vagy a meghatározzuk a célról, hogyan jön ki, és visszafelé haladva jutunk el az adatokig.
3 tipp ami segítheti a megoldást:
- Amikor kapsz egy számítási példát, érdemes lehet egy gyors vázlatot készíteni, hogy lásd, milyen lépéseken keresztül jutsz el a megoldásig. (Miből mi fog kijönni, milyen összefüggéssel, azt mihez lehet tovább használni…)
- Nagyban megkönnyítheti a munkát a megoldási háló/vázlat mellett, ha egy egyszerű rajzot/ábrátkészítesz a feladat lényegéről. Így gyorsan átlátod, megérted, hogy miről is van szó pontosan a példában. Az egyes részeket, lépéseket, az egyforma, de másra vonatkozó mennyiségeket (pl. oldott anyag és oldat tömege, oldószer és oldat sűrűsége), stb. különítsd el!
- Szintén jó segítség lehet az adatok rendszerezésekor egy táblázatba foglalni azokat, nem csak egymás alá felírni. Ez is megkönnyítheti a lépések átlátását.
(A feladat szövege két adatot közvetetten ad meg: a nátrium-hidroxid moláris tömege a periódusos rendszer segítségével számolható (40,0 g/mol), a desztillált víz sűrűsége pedig 1,00 g/cm3-nek vehető, ha nincsen pontosabban megadva.)
Ábra a feladat lényegéről:
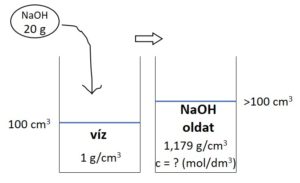
(Kattints a képre nagyításhoz!)
Megoldási háló:
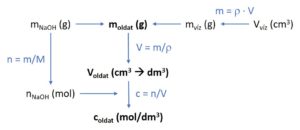
(Kattints a képre nagyításhoz!)
Táblázat:
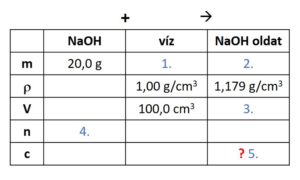
(Kattints a képre nagyításhoz!)
Használd legalább az egyiket a 3 közül, és máris jobban át fogod látni a feladatot, és a megoldások menetét.
8. Üresen hagyod, ha nem tudod megoldani a számolást
Ez még egy-egy részfeladaton belül is hiba, de még nagyobb baj, ha egy feladat b), c) stb. részeid nem oldod meg azért, mert nem sikerül az a) rész! Sok olyan eset van, amikor egy számolási feladat részfeladatait egymástól teljesen függetlenül is meg lehet oldani. Ha nem megy valamelyik, attól még a többi részre maximális pontszámot is kaphatsz!
Ha egy részfeladat nem megy:
Először is alkalmazd a 7-es pontban bemutatott tippek valamelyikét (ábra, megoldási vázlat, táblázat), hátha így jobban átlátod a lényeget.
Fontos megértened, hogy az értékelésnél nem csak azt nézik, hogy jó végeredmény jött-e ki, hanem részpontokat adnak a számolás kulcslépéseire, részeredményeire is. (Sőt, a részeredmények még fontosabbak is, hiszen ha csak egy végeredményt írsz be számolás, levezetés nélkül, akkor csak a végeredményért – mint részlépésért – járó 1-2 pontot kapod meg). Így, ha nem jön ki egy végeredmény, elszámolsz valamit, stb. akkor nem 0 pontot fogsz kapni a feladatra. Néhány részpontot kapni pedig még mindig jobb, mint semennyit!
Ezek között a részeredmények között mindig van olyan, ami alapvető, szinte minden típusfeladatnál előforduló számolási lépés, amelyeket az adatokra ránézve azonnal, automatikusan számolhatsz. Ezekért az egyszerű számolásokért is általában simán 1-2 részpont szokott járni.
Például, ha meg van adva egy tömeg és egy térfogat, máris számolhatsz sűrűséget. Ha meg van adva egy oldat koncentrációja és térfogata akkor azonnal számolhatod az oldott anyag anyagmennyiségét. Egy anyagmennyiségből azonnal számolható a tömeg, csak megnézed a periódusos rendszerből a moláris tömegét, és már szorzod is össze; gázok esetén a térfogatot is megkaphatod, csak megszorzod a feladatban leírt állapotnak megfelelő térfogattal.
Tehát, ha egyáltalán nem megy egy feladat, egy-két ilyen részszámolással pontokat kell menteni. De nem ritka eset az sem, hogy valaki ezek kiszámolása után világosodik meg, meglátja az eredményekből, hogy mit lehetne tovább számolni, és akár a teljes megoldásig is eljuthat.
C4H10O (f) + C2H4O2 (f) ⇌ C6H12O2 (f) + H2O (f) K = 2,02
c) Mekkora tömegű tiszta 2-metilpropán-1-olt és tiszta ecetsavat kell összekeverni 25 °C-on, hogy az egyensúlyi elegy 1,00 kg észtert tartalmazzon, az alkohol átalakulása pedig 95%-os legyen?
Ez bizony egy nem az egyszerűbb számolások közül való, egyensúlyos feladat. Tegyük fel, hogy nem is tudjuk megoldani. Akkor legalább mentsünk meg néhány pontot! Látunk egy tömeg adatot (1,00 kg) az észterre, máris számoljuk az anyagmennyiséget: 1000,00/116,2 = 8,61 mol. Ezt meg is érte kiszámolni, mert a megoldókulcs alapján máris szereztünk 1 pontot!
Most jön egy kisebb megvilágosodás: a kérdés egyik felét meg tudjuk válaszolni, hiszen a szükséges alkohol mennyiségét ki lehet számolni, mivel az egyensúlyi reakcióban az észter és az alkohol 1:1 mólarányban vesz részt (ez a reakcióegyenletből látszik). Márpedig az észter móljainak számát most számoltuk ki, és az is meg van adva, hogy az egyensúlyi elegyben az alkohol átalakulása 95%-os. Vagyis az alkohol kiindulási anyagmennyisége 8,61/0,95 = 9,06 mol. Akkor most van egy anyagmennyiség adatunk, már számolhatjuk is a tömeget: 74,14*9,06 = 672 g.
Erre az egyszerű osztásra és szorzásra a megoldókulcs további 2 pontot ad. Vagyis
Nem is olyan rossz… (Te meg tudod végig oldani? Írd le kommentben, hogy jön ki a végeredmény!  )
)
Ha nem jut eszedbe a számolási képlet:
Előfordulhat, hogy a vizsgadrukk miatt, vagy bármi más okból elfelejtesz egy képletet, illetve, hogy egy adott képletet nem tudsz átalakítani a kellő formába. Mit lehet ilyenkor tenni? Először is, gondold át, hogy mi a képletben szereplő mennyiségek mértékegysége. Ebből máris ki lehet logikázni, hogy mi is a képlet.
Például nem jut eszedbe a sűrűség számolási képlete, de tudod, hogy egy sűrűség adat mértékegysége g/cm3. Tehát, ha van egy tömeg (g) és egy térfogat (cm3) adatunk, akkor abból úgy lesz g/cm3 mértékegységű eredmény, ha a tömeget osztjuk a térfogattal. A sűrűség képlete tehát: ϱ = m/V.
Tegyük fel, hogy tudod ezt a képletet, de térfogatot kell számolni, és nem tudod átalakítani. Megint csak a mértékegységeket kell nézni: az eredményről tudod, hogy cm3 mértékegységű, és van egy sűrűség adatod (g/cm3), illetve egy tömeg adatod (g). Ezekből csak úgy lehet ,,kiejteni” a g-ot, ha a tömeget osztjuk a sűrűséggel. Vagyis az átalakított képlet: V = m/ϱ.
Ha így sincs meg a képlet, akkor számolj helyette következtetéssel:
Láncfeladatok:
Az viszonylag nyilvánvalóbb tanács volt, hogyha a feladatrészek egymástól függetlenül megoldhatóak, akkor nem hagyunk üresen egy teljes feladatot azért mert nem ment az első része. De mi a helyzet, ha olyan feladat van (ún. láncfeladat), ahol az előző részfeladat eredményét fel kell használni a következő részfeladatban? Ebben az esetben már tényleg nincs mit tenni, igaz? NEM!
A kémia érettségin a számolási feladatok javítása úgy működik, hogyha valamit elszámolsz véletlenül, akkor a javító tanár arra a lépésre levon 1-2 pontot, de ha a továbbiakban a hibás eredménnyel jól számoltál tovább, akkor azon az 1-2 ponton kívül az összes többi jár a feladat megoldásáért.
Ez csak abban az esetben nem igaz, ha akkora hibát (ún. súlyos elvi hibát) vétesz, ami annyira egyértelmű, hogy fel kellett volna tűnjön neked (pl. negatív a koncentráció, 5 g porkeverékből az egyik összetevőre 8 g jön ki, stb.)
Vagyis,
(Esetleg megjegyzésként odaírhatod, hogy nem tudtad megoldani, de a további számolások érdekében ezt az eredményt használod, ezzel jelzed a javítónak, hogy miről van szó). Ha ezzel az eredménnyel jól számolod ki a következő részfeladatot, akkor arra akár maximális pontszámot is kaphatsz!
Persze nem lehet csak úgy hasra ütés-szerűen bármilyen végeredményt betippelni. Ahogy már írtam, valamennyire azért reálisnak kell lennie. Annak érdekében, hogy egy ilyen tippet reálisan tudj megadni, érdemes már a felkészülés során próbálgatni még a feladatba kezdés előtt, hogy mennyire tudod jól megbecsülni a végeredményt.
a) Mekkora a telített cink-szulfát-oldat sűrűsége?
b) Mekkora térfogatú oldat maradt vissza az üvegben?
c) Hány g víz párolgott el állás közben az üvegből?
Tegyük fel a következő esetet: kiszámoltuk az a) részt (ϱ = 1,383 g/cm3 ), de a b) részt már nem tudjuk hogyan kellene. Ha tovább megyünk a c) részre, akkor látjuk, hogyha ki tudnánk számolni a keletkező (telített oldat) tömegét, akkor a c) részt meg tudnánk oldani (az elpárolgott tömeg = az oldat tömegcsökkenése, mínusz a szilárd anyagként kivált tömeg).
Ehhez viszont kellene a b) rész megoldása: az oldat térfogata, mert a sűrűséggel megszorozva kapnánk meg a tömeget (a tömegszázalék és az oldott anyag anyagmennyiségéből is lehet számolni, de az utóbbi is a b) kérdés egyik részeredménye, ami szintén nincs meg).
Ekkor a következőt tesszük: a b) rész eredményére betippelünk valamit. Legyen mondjuk az eredeti oldat térfogatának a fele: 250,0 cm3 . Ez nagyjából reálisnak tűnik. Ennek az adatnak a felhasználásával pedig szépen megszerezzük a c) feladat összes pontját! (Az így számolt végeredmény: 199,9 g).
Miután kész vagyunk, észrevesszük, hogy van még egy információ a feladat szövegében, amit eddig semmire sem használtunk: egy koncentráció adat.
Mivel nagyon ritkán van felesleges adat megadva, ezért ezt feltehetőleg a b) feladatrészben kellett volna használni. Nem tudjuk megoldani a b) részt, de ebből az adatból kiszámoljuk amit automatikusan lehet: (a megadott térfogattal) az oldott anyag anyagmennyiségét (n(ZnSO4) = 1,000 mol). Erre a részeredményre egyébként a megoldókulcs valóban ad is 1 pontot!
Végül megnézzük, hogy a megadott adatokból mi az amit kapásból ki lehet számolni, de még egyik feladatnál sem számoltuk, és ezeket is beírjuk a b) részhez, hátha jár érte pont. Ilyen számolás most 1 van: a tömeg adatból (a moláris tömeggel) a kivált kristályvizes cink-szulfát anyagmennyiségét lehet meghatározni (n(ZnSO4·7H2O) = 0,05000 mol). Ez a számolás szintén további 1 pontot ért!
Ezzel a módszerrel az egész 12 pontos feladatból csak 2 pontot veszítünk, pedig a b) és c) rész végeredménye nem is az mint ami a megoldókulcsban van!
Hasonló taktikát lehet alkalmazni, ha nem tudsz rendezni egy reakcióegyenletet, de annak alapján kellene tovább számolni: vegyél az egyenletben mindent 1-es együtthatóval!
Egy vegyület képletét/nevét kell meghatározni és azt felhasználni utána? Ha nem tudod meghatározni, tippelj egy ugyanolyan típusú vegyületet! (Pl. ha egy szekunder amin a megoldás, akkor egy szekunder amint).
9. Nem vagy leleményes
Ha valamelyik feladat nem megy a kémia érettségin, érdemes egy picit szemfülesnek lenni! Ez alatt azt értem, hogy tegyél meg mindent annak érdekében, hogy rájöjj a megoldásra! Persze nem puskázásra kell gondolni, hanem csak egy kis leleményességre.
Van-e pl. utalás a feladat szövegében, vagy a feladat jellegéből adódóan a megoldásra?
Ki lehet-e valahogy a periódusos rendszer, vagy a függvénytáblázat segítségével hozni a megfejtést?
Van-e valamelyik másik feladatban olyan dolog amiről eszedbe juthat a megoldás? Pl. ha nem tudsz egy reakcióegyenletet, akkor nézd meg a többi feladatot. Nem szerepel valamelyikben véletlenül ugyanaz, vagy legalább hasonló amiről beugrik? (Pl. találhatsz egy egyenletet amivel egy oldalon volt a jegyzeteidben kigyűjtve a kérdéses egyenlet, és így eszedbe jut).
Nézzünk konkrét példákat, hogy jobban megértsd mire gondolok:
10,0 cm3 térfogatú karbonsavból mekkora térfogatú pH = 3,00-as oldat készíthető el?
A lényeg, hogy (ha már minden más feladattal kész vagy) addig próbálkozz, keresgélj, amíg csak lehet, ne add fel és gyere ki hamarabb, mint ahogy vége a vizsgának. Ha már fogytán az idő, akkor végső esetben pedig tippelj, és semmit se hagyj üresen!
Összefoglalva