Nemes akarok lenni!
Miután az elektronok beköltöztek a szállodába és néhányan el is költöztek az elektronjaink új kapcsolatokat kezdtek el építeni.
Mielőtt folytatnánk a mesét vizsgáljuk meg a VIII. főcsoport elemeit, vagyis a nemesgázokat.
Nevükből kifolyólag érthető, hogy halmazállapotuk gáznemű, de miért „nemesek”?

Ahogy láthatjuk a hélium esetében 2 elektron van az utolsó szinten, de mivel az első csoportban van, több nem is lehetséges. Az ezt követő elemeknél a külső szinten 8 elektron van (elektronoktett), nemcsak a neon és az argon esetében, hanem a többi „nemesnél” is. Ez az állapot (a külső héjon lévő 8 elektron) az atom számára a legelőnyösebb, legstabilabb állapot. Fogalmazzunk úgy, hogy akkor a legboldogabb egy atom, ha elérte ezt az állapotot. Mivel a nemesgázok már eleve ilyen szerkezettel rendelkeznek, ők így boldogak. Nincs szükségük senkire, nem „közösködnek” senkivel, egyedül „élnek” (azaz egyszerű anyagaik különálló atomokból épülnek fel), igazi NEMESEK. Ezt a szerkezetet nemesgázszerkezetnek nevezzük.
A többi elem persze szeretne rájuk hasonlítani, azaz törekszenek a nemesgázszerkezetre. De mivel az ő elektronszerkezetük alapjában véve nem stabil, ezért különböző kötések kialakításával érik el ezt az állapotot. Elsőrendű kémiai kötésnek nevezzük a két vagy több atom között létrejövő erős kötést. Ezek kialakításában a külső szinten lévő (azaz a legfelső emeleten élő) elektronok vesznek részt. Elsőrendű kötés az ionos, a kovalens és a fémes kötés. De hogyan döntsük el, hogy milyen kapcsolatot (kötést) alakít ki két vagy több atom egymással?
Az atomok fontos tulajdonsága az elektronegativitás (elektronvonzó képesség). Ha a periódusos rendszert vesszük alapul, akkor az atomok ezen tulajdonsága balról jobbra és lentről felfelé növekszik.
Mivel a nemesgázoknak nincs szükségük más atomok elektronjaira, ezért nem is vonzzák őket.
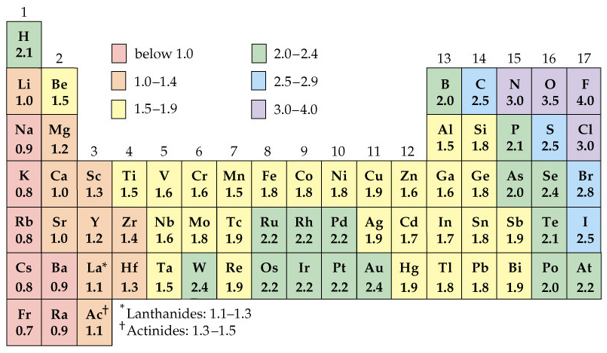
Ahogy az ábrán láthatjuk a nemfémes elemek magas elektronegativitással rendelkeznek, míg a fémeknél ez az érték alacsony. Fogalmazzunk úgy, hogy a nemfémek szépek a fémek pedig… hát csúnyácskák… Szóval ha két olyan elem találkozik, amelyeknél nagy az elektronegativitás-különbség (fémes és nemfémes elem), akkor az elektronok otthagyják a csúnya fémet és átköltöznek a nemfémes elemhez. De mindenki boldog lesz! Vizsgáljuk meg ezt a konyhasó példáján.
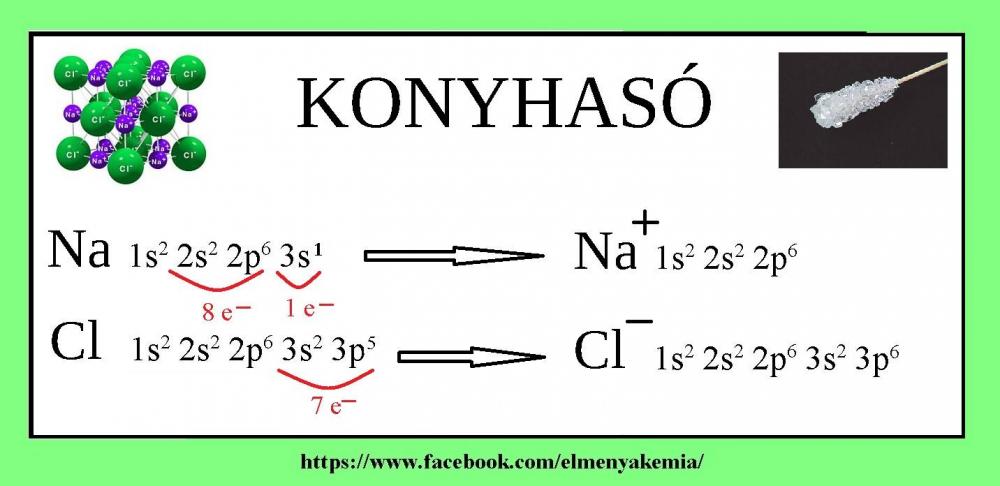
Ahogy láthatjuk a nátrium atom felső emeletén 1 db elektron van. Ahogy mindenki más, így a nátrium is arra törekszik, hogy a külső szintjén 8 elektron legyen, akkor lesz boldog. Nyilvánvalóan sokkal könyebb leadni 1 elektront (ezáltal az előző szint lesz a külső 8 elektronnal), mint felvenni 7 elektront. Tehát a nátrium atom lead egy elektront ezáltal Na+ ionná alakul. A klór esetében éppen ellenkezőleg. Külső szintjén 7 elektron van, tehát a boldogsághoz szüksége van még egy elektronra, ezáltal Cl- ionná alakul. De kitől kaphatna egy elektront? Gondolom kitaláltátok… Hát a nátriumtól!
Így pedig mindenki boldog, hisz elérték a nemesgázszerkezetet. Ha a fém két elektronnal rendelkezik a külső szinten, akkor „2+”-töltésű ionná alakul. Például ha a kálcium találkozik a klórral, akkor ahhoz, hogy a kálcium mindkét elektronjának helye legyen, két klóratomra van szüksége, azaz képlete CaCl2 lesz. S bár fémes elemeink elvesztették elektronjaikat mégis boldogak. Ezekben az anyagokban ionos kötés jön létre. Vagyis az ellenkező töltéssel rendelkező ionok közötti kölcsönhatást ionos kötésnek nevezzük. Szilárd állapotban az ionos anyagok kristályos felépítésűek, azaz az ionok kristályrácsot képeznek (ahogy a képen is látható), melyben az ionok szigorú sorrendjét figyelhetjük meg. Ennek köszönhető a szép kristályos forma.
Szép sókristályokat otthon is növeszthetünk. Ehhez szükségünk lesz egy pohár lehűtött forralt vízre, amibe addig adagoljuk a sót, amíg több már nem olvad el benne kavargatás után sem. Ezután vattán keresztül leszűrjük az oldatot és egy tiszta pohárba öntjük, majd egy ceruza segítségével egy darab cérnát lógatunk bele. Olyan helyre tegyük, ahol nincs mozgás. Néhány naponta ellenőrrizzük a cérnára lerakódott kristályokat: a kisebb darabokat szedjük le, esetleg szűrjük át, vagy készítsünk új sóoldatot. Néhány hét alatt nagyon szép, akár 4-8 mm szélességű sókristályokat kaphatunk Természetesen minél türelmesebbek vagyunk, annál nagyobb lesz a kristály.


Sponták Anett - kémia tanárnő, Munkácsi II. Rákóczi Ferenc Középiskola;
az Élmény a kémia facebook oldal szerkesztője